Todo lo que los pacientes deben saber sobre Aduhelm (aducanumab) | New Alzheimer's Medicine
Última actualización: 15 de marzo de 2022

Puede acceder legalmente a los nuevos medicamentos, aunque no estén aprobados en su país.
Más información "Artículo revisado por el Dr. Jan de Witt
El 7 de junio de 2021, la FDA aprobó el aducanumab (producido bajo el nombre comercial "Aduhelm") para el tratamiento de la enfermedad de Alzheimer, lo que suscitó las esperanzas de millones de pacientes de Alzheimer y sus familias en todo el mundo, mientras que los expertos expresaron su preocupación por la decisión.
Aduhelm es el primer medicamento para la enfermedad de Alzheimer aprobado por la FDA en 18 años. Este medicamento pretende, según los resultados publicados, ser capaz de ralentizar la progresión de la enfermedad de Alzheimer en sí, más que aliviar sus síntomas.
La decisión de la FDA de aprobar el medicamento ha estado cargada de polémica. No obstante, Biogen, el fabricante de Aduhelm, espera empezar a enviar Aduhelm a más de 900 centros sanitarios de Estados Unidos a finales de junio de 2021.
Aduhelm está actualmente disponible para los pacientes adecuados fuera de los Estados Unidos en régimen de uso compasivo o de paciente designado. Obtenga más información accediendo a la sección "Acceso a Aduhelm fuera de los Estados Unidos".
La enfermedad de Alzheimer: una de las mayores crisis sociales, médicas y económicas del siglo XXI
La enfermedad de Alzheimer es un trastorno cerebral degenerativo que hoy afecta a más de 40 millones de personas en todo el mundo y es la causa más común de demencia. Aunque durante muchos años se creyó que era una parte normal del envejecimiento, ahora se reconoce que la enfermedad de Alzheimer es una afección con graves repercusiones sanitarias, económicas y sociales.
Los investigadores aún no comprenden del todo las causas de la enfermedad de Alzheimer, pero se cree que está causada por una combinación de factores, como:
- Envejecimiento: El Alzheimer se diagnostica con mayor frecuencia después de los 65 años (enfermedad de Alzheimer de inicio tardío). Aproximadamente un tercio de las personas de 85 años o más padecen la enfermedad de Alzheimer. Los cambios en el cerebro relacionados con el envejecimiento pueden contribuir a desarrollar la enfermedad.
- Antecedentes familiares: Tener un familiar de primer grado con Alzheimer aumenta el riesgo de que una persona desarrolle la enfermedad. Los científicos creen que una predisposición genética puede causar el Alzheimer de inicio temprano, que se da en personas de entre 30 y 60 años. Sólo el 10% de los pacientes de Alzheimer tienen la forma de inicio temprano de la enfermedad.
- Otros factores: Los científicos han encontrado vínculos entre el deterioro cognitivo y las enfermedades cardíacas, así como la diabetes y la obesidad. Las pruebas más sólidas relacionan la salud del cerebro con la del corazón. Los traumatismos craneales también se han relacionado con un mayor riesgo de Alzheimer, ya que pueden desencadenar la formación de placas amiloides. Las personas con síndrome de Down, en las que un cromosoma extra dicta la codificación genética de un tipo de proteína amiloide vinculada al Alzheimer, también tienen un mayor riesgo.
La mayoría de las personas con Alzheimer son diagnosticadas en la fase leve, cuando los síntomas se acentúan y la enfermedad ya ha causado algún daño cerebral, a pesar de que algunos síntomas empiezan a aparecer incluso una década antes del diagnóstico. Los síntomas tempranos pueden ser ignorados por los pacientes (a menudo debido a la vergüenza) o simplemente no percibidos por los médicos o los familiares. Los pacientes tienen una esperanza de vida media de 3 a 11 años tras el diagnóstico.
"Con el tiempo, mamá olvidó quién era yo"
La enfermedad de Alzheimer tiene tres etapas diferentes:
- Leve: En las primeras etapas, los pacientes experimentan pérdidas de memoria tales como el olvido de fechas y acontecimientos importantes, la repetición frecuente de preguntas, la tardanza en completar las tareas diarias, los problemas constantes con las finanzas, el extravío frecuente de objetos y la ansiedad. (Para saber más sobre el grado de pérdida de memoria que es normal con el envejecimiento, consulte esta infografía del Instituto Nacional de la Salud (NIH)).
- Moderada: A medida que la enfermedad avanza, los pacientes presentan una mayor pérdida de memoria y confusión, dificultad para comunicarse y leer, dificultad para realizar tareas rutinarias como vestirse, problemas para reconocer a familiares y amigos, paranoia, alucinaciones y deambulación.
- Grave: Los pacientes con Alzheimer grave experimentan incapacidad para comunicarse, pérdida de peso, dificultad para tragar y pérdida de control de esfínteres. En esta fase, los pacientes están en cama la mayor parte del tiempo y dependen totalmente de otros para su cuidado.
Las dificultades de los enfermos de Alzheimer son terribles, ya que la enfermedad afecta a todos los aspectos de su vida cotidiana. A continuación puede leer algunas historias de pacientes o de amigos y familiares de pacientes.
Sandy, antiguo dentista y profesor adjunto de Harvard, habló con los periodistas de la CNN sobre su constatación de que sus olvidos habían progresado hasta convertirse en algo peor: "'Estoy mirando un expediente de un caso dental durante una hora y media', recuerda. Lo estoy leyendo, está en mi cerebro. Luego cerraba el expediente y no recordaba literalmente nada del caso'". Poco después le diagnosticaron la enfermedad de Alzheimer.
Fred Walker, cuya esposa ha sido diagnosticada con la enfermedad de Alzheimer, habló con Alzheimer's Research UK sobre su mujer: "'Usar el teléfono se convirtió en algo superior a sus capacidades. No podía dominar todos los botones. La cocina era demasiado compleja de entender y siempre existía el peligro de que dejara el gas abierto. Preparar una taza de té era demasiado y se confundía en cuanto a la cantidad de té, leche y agua que necesitaba".
La enfermedad de Alzheimer, cuando alcanza las últimas fases y progresa hacia la demencia, es descrita por Laury para la Alzheimer's Society:
"[...] nos embarcamos en un nuevo viaje. Un viaje que implicaba cuidados las 24 horas del día, rondas diarias de medicación y que mamá se perdiera completamente en la niebla de su propia mente. [...] Hasta ese momento no se comprendió todo el espectáculo de horror que suponía ver a un ser querido con esta cruel e insidiosa enfermedad. [...] Empezó a alucinar".
everyone.org fundador Sjaak Vink confirma y reconoce todas y cada una de estas descripciones. A su madre le diagnosticaron Alzheimer en 2015.
Es un camino difícil para los pacientes y sus seres queridos, y la enfermedad no se limita a afectar sólo a su vida personal y a la de sus seres queridos.
Presión sobre los cuidadores, los presupuestos y los responsables políticos
Los pacientes con Alzheimer requieren unos cuidados cada vez más exigentes a medida que su estado se deteriora, como atención en el hogar, cuidados nocturnos, servicios de limpieza o cuidados de enfermería; con el tiempo, los pacientes pueden necesitar vivir en centros de vida asistida o residencias de ancianos. La enfermedad se cobra un alto precio en el paciente, en los miembros de su familia (que a menudo se dedican a cuidar del paciente), y en los presupuestos personales y del Estado.
Los cuidadores familiares se enfrentan a una difícil misión cuando atienden a sus seres queridos con la enfermedad de Alzheimer. Según una encuesta, el 95% de los cuidadores familiares del Reino Unido afirman que la enfermedad afecta a su salud física o mental, el 69% afirma sentirse constantemente agotado, el 64% se siente ansioso y el 49% deprimido.
En Europa, la enfermedad de Alzheimer y otras formas de demencia afectan a unos 10 millones de personas y se prevé que la cifra aumente a 14 millones en 2030. Se calcula que el coste económico de la demencia en Europa aumentará a más de 250.000 millones de euros en 2030, de los cuales más del 50% se deben a los costes de los cuidados informales. El acceso a los cuidados y al tratamiento es desigual y, sobre todo en Europa del Este, faltan sistemas de apoyo y programas sociales para los enfermos de Alzheimer y sus cuidadores.
En Estados Unidos, la enfermedad de Alzheimer ha entrado recientemente en la lista de las 10 principales causas de muerte y es la única de las 10 que no tiene cura conocida. Afecta a 6 millones de personas en Estados Unidos y se prevé que la cifra aumente a 12 millones en 2050. A finales de 2021, el coste nacional total del cuidado de las personas con Alzheimer y otras demencias podría alcanzar los 355.000 millones de dólares y se prevé que llegue a 1,1 billones en 2050.
Esta financiación, por astronómica que parezca, es necesaria para ofrecer a los pacientes un apoyo adecuado y, en la medida de lo posible, una vida digna.
Debido a los cuidados que requieren las 24 horas del día, especialmente en las últimas etapas, los pacientes con Alzheimer se ven especialmente afectados cuando su atención es inadecuada, lo que ocurre en muchos países o comunidades. Sólo en el Reino Unido, decenas de miles de personas con demencia son ingresadas en urgencias cada año debido a infecciones, caídas y deshidratación, resultado de una atención insuficiente. Esto supone una carga adicional para los presupuestos sanitarios nacionales.
Durante la pandemia de COVID-19, los pacientes de Alzheimer se han visto gravemente afectados y han sufrido un elevado número de muertes debido a la edad, a otras condiciones de salud a largo plazo y a los propios retos del Alzheimer (por ejemplo, problemas de memoria y confusión que hacen que los pacientes tengan dificultades para seguir las pautas que previenen las infecciones de COVID-19).
Los enfermos de Alzheimer internados en residencias también han sentido las consecuencias perjudiciales de otras maneras. Debido a los cuidados insuficientes y a la separación forzosa de sus seres queridos para mantenerlos a salvo del COVID-19, la soledad y el aislamiento resultantes han deteriorado aún más su salud mental y física.
Se necesitan tratamientos eficaces para la enfermedad para evitar que la crisis sanitaria y económica alcance proporciones graves.
Lo más destacado en la investigación de la enfermedad de Alzheimer
En 1910, el médico alemán Emil Kraepelin bautizó la enfermedad con el nombre de "enfermedad de Alzheimer " en honor al médico Alois Alzheimer, que descubrió los rasgos patológicos de la demencia presenil en un paciente con una profunda pérdida de memoria y un empeoramiento de los cambios psicológicos. La investigación de tratamientos para la enfermedad de Alzheimer no comenzó hasta finales de los años 80 en Estados Unidos, pero se enfrentó a las críticas ya que los médicos seguían creyendo que el Alzheimer era una consecuencia inevitable del envejecimiento.
En Estados Unidos, en 1978, el Instituto Nacional sobre el Envejecimiento (NIA) y la Asociación de Alzheimer se asociaron con Pfizer e iniciaron el primer ensayo clínico de un medicamento para tratar los síntomas de la enfermedad de Alzheimer. El medicamento fue aprobado en 1993: Cognex (tacrina), según los resultados publicados, mejoró las capacidades cognitivas de algunos pacientes, pero no impidió que la enfermedad empeorara.
En la década siguiente se aprobaron seis medicamentos más, todos ellos para tratar los síntomas cognitivos de la enfermedad de Alzheimer:
- Aricept (donepezilo): para tratar los síntomas relacionados con la memoria y el pensamiento
- Razadyne (galantamina): para tratar los síntomas relacionados con la memoria y el pensamiento
- Exelon (rivastigmina): para tratar los síntomas relacionados con la memoria y el pensamiento
- Namenda (memantina): para mejorar la memoria, la atención, la razón y el lenguaje
- Namzaric (memantina + donepezilo): una combinación de los anteriores
- Belsomra (Suvorexant): para el tratamiento del insomnio en pacientes con Alzheimer
El último medicamento aprobado para el tratamiento de la enfermedad de Alzheimer lo fue en 2003. Durante décadas, la enfermedad de Alzheimer se consideró una consecuencia natural del envejecimiento. Se dedicaron pocos recursos a encontrar un tratamiento, ya que se debatía si era una enfermedad real. En los últimos 20 años, sin embargo, los investigadores han dedicado amplios recursos a estudiar la enfermedad y desarrollar un tratamiento.
La falta de tratamientos para el Alzheimer no se debe a la negligencia de las empresas farmacéuticas: la industria en general ha invertido miles de millones en investigación. Sólo la empresa Eli Lilly ha gastado 4.200 millones de dólares durante tres décadas para tratar de desarrollar un medicamento exitoso, y los Institutos Nacionales de Salud (NIH) de Estados Unidos han gastado más de 500 millones de dólares al año en la investigación y el desarrollo de tratamientos.
Desde 2013, El Congreso de los Estados Unidos ha triplicado el presupuesto anual de los NIH para la financiación de la investigación del Alzheimer y las demencias relacionadas, alcanzando los 3.100 millones de dólares en 2019.
La financiación nacional y privada ha dado lugar a 2173 ensayos clínicos que se han realizado en 2019 para probar diversas teorías. Las principales teorías probadas:
- El 19% de los ensayos se centró en la hipótesis de un neurotransmisor
- El 17,0% de los ensayos probaron la hipótesis de la cascada mitocondrial y otras hipótesis relacionadas
- El 12,7% probó la hipótesis de la propagación de tau
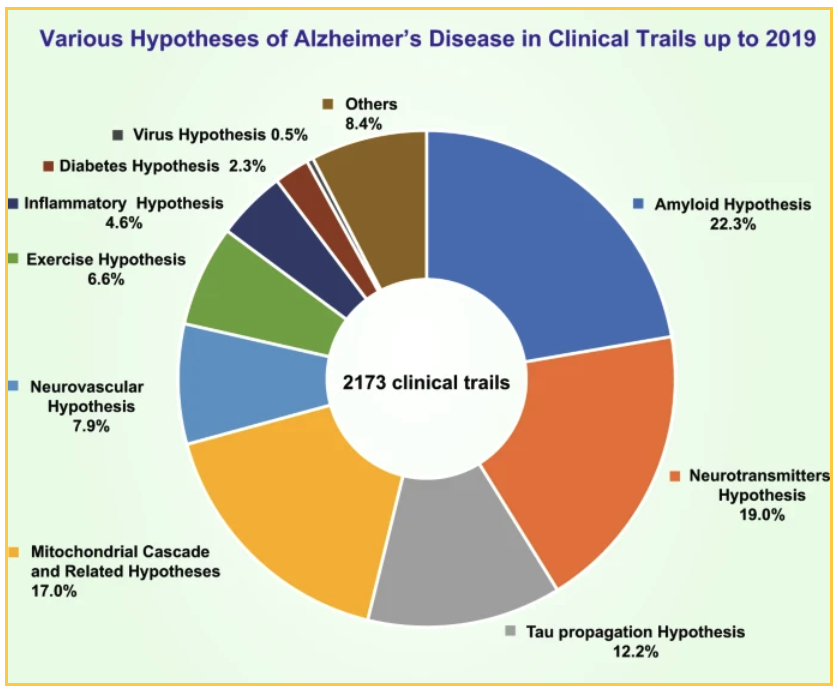
El 22,3% de los ensayos que tienen como objetivo el amiloide se centran en diferentes formas de reducir la placa:
- Anticuerpos generados por el sistema inmunitario contra el beta-amiloide: "Vacunas activas" que, cuando se inyectan en el cuerpo, hacen que el sistema inmunitario produzca anticuerpos para destruir el beta-amiloide y reducir los niveles de beta-amiloide en el cerebro.
- Anticuerpos contra el beta-amiloide producidos en laboratorio: "Vacunas pasivas", que se consideran más eficaces y seguras que intentar inducir la producción de anticuerpos en el organismo.
- Disminución de la producción de beta-amiloide: Algunos tratamientos experimentales cambian el comportamiento de ciertas proteínas que pueden prevenir o reducir la producción de beta-amiloide.
- Prevención de la agregación de beta-amiloide: Los científicos están investigando fármacos que impidan las interacciones iniciales entre el beta-amiloide y las células cerebrales que conducen a la muerte de la célula cerebral.
- Aumentar la eliminación del beta-amiloide: Técnicas como la movilización del sistema inmunitario para que ataque al beta-amiloide o la administración de agentes naturales con efectos anti-amiloides.
- Agentes naturales con efectos antiamiloides: La inmunoglobulina intravenosa (IVIg) obtenida de donantes de sangre humana contiene anticuerpos naturales que pueden reducir los niveles de beta-amiloide.
¿Qué es Aduhelm (aducanumab-avwa)?
Aduhelm (aducanumab) es un anticuerpo antiamiloide indicado para el tratamiento de la enfermedad de Alzheimer. Está diseñado para eliminar las placas de beta-amiloide que se forman entre las células cerebrales en cantidades anormales en pacientes con la enfermedad de Alzheimer, lo que provoca la muerte de las células cerebrales afectadas. El beta-amiloide se identificó en 1984 y rápidamente se consideró el principal desencadenante del daño de las células cerebrales, mientras que en 1986 se identificó la proteína tau, componente clave de los ovillos y segundo desencadenante del deterioro de las células cerebrales.
Aduhelm fue desarrollado por Biogen, Inc., una empresa multinacional de biotecnología con sede en Massachusetts, Estados Unidos. Aduhelm se administra en forma de inyección mensual.
Aduhelm tiene una larga historia.
La empresa suiza de biotecnología Neurimmune Therapeutics AG, en colaboración con la Universidad de Zúrich, identificó los anticuerpos protectores contra el amiloide en ancianos sanos y en pacientes con demencia de progresión lenta y condujo al descubrimiento del aducanumab, el principio activo de Aduhelm. En pacientes con enfermedad de Alzheimer leve, un año de infusiones intravenosas mensuales de aducanumab reduce la placa amiloide, lo que se traduce en una ralentización del deterioro cognitivo.
Neurimmune concedió a Biogen la licencia de aducanumab para el tratamiento de la enfermedad de Alzheimer en 2007 y trabaja en colaboración con Biogen en su desarrollo.
¿Cómo funciona Aduhelm ?
La enfermedad de Alzheimer parece ser el resultado de la acumulación inusual en el cerebro de dos proteínas, la beta-amiloide y la tau. La beta-amiloide es una proteína normalmente presente en el cerebro que, en la enfermedad de Alzheimer, se aglutina en placas amiloides entre las células cerebrales; la teoría del amiloide afirma que estas placas dañan y acaban matando las células cerebrales. Las placas amiloides parecen desarrollarse en una fase más temprana de la enfermedad, mientras que los ovillos de tau tienden a aparecer más tarde. Gran parte de las investigaciones que se han llevado a cabo para encontrar un tratamiento para la enfermedad de Alzheimer se han centrado en la eliminación de las placas amiloides.
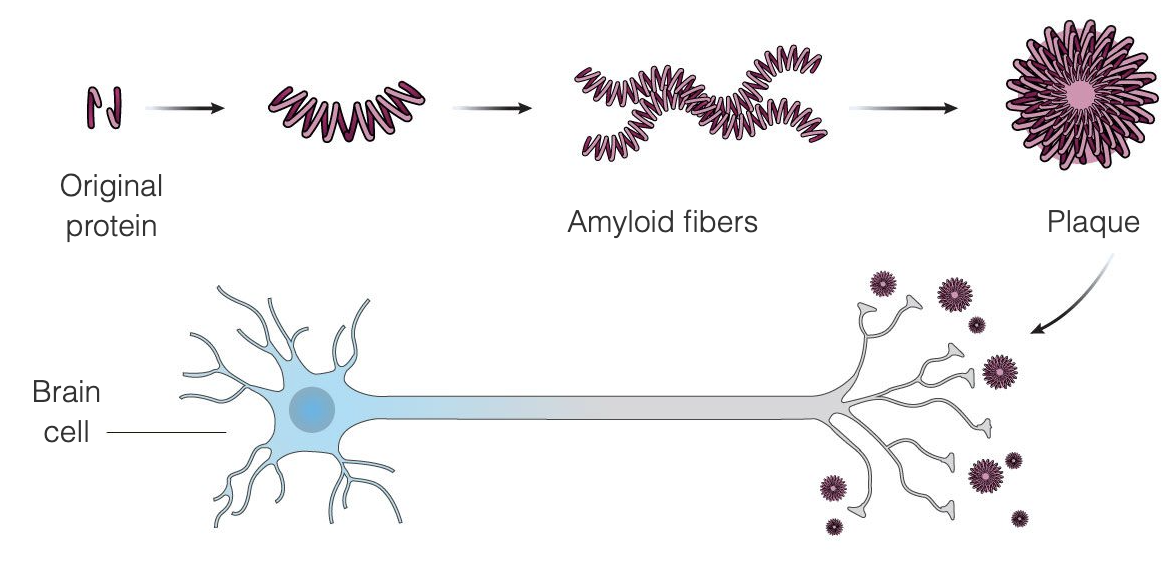
Aduhelm está diseñado para tratar el Alzheimer en las primeras fases de la enfermedad al unirse a las placas amiloides, lo que provoca que el sistema inmunitario destruya las placas, considerándolas un invasor extraño. La intención es que, una vez eliminadas las placas, las células cerebrales dejen de morir y la función cognitiva deje de deteriorarse. Aduhelm utiliza este mecanismo con el objetivo de ralentizar la progresión de la enfermedad, dirigiéndose especialmente a los pacientes en las primeras fases de la enfermedad de Alzheimer. Aduhelm no revierte los daños ya producidos.
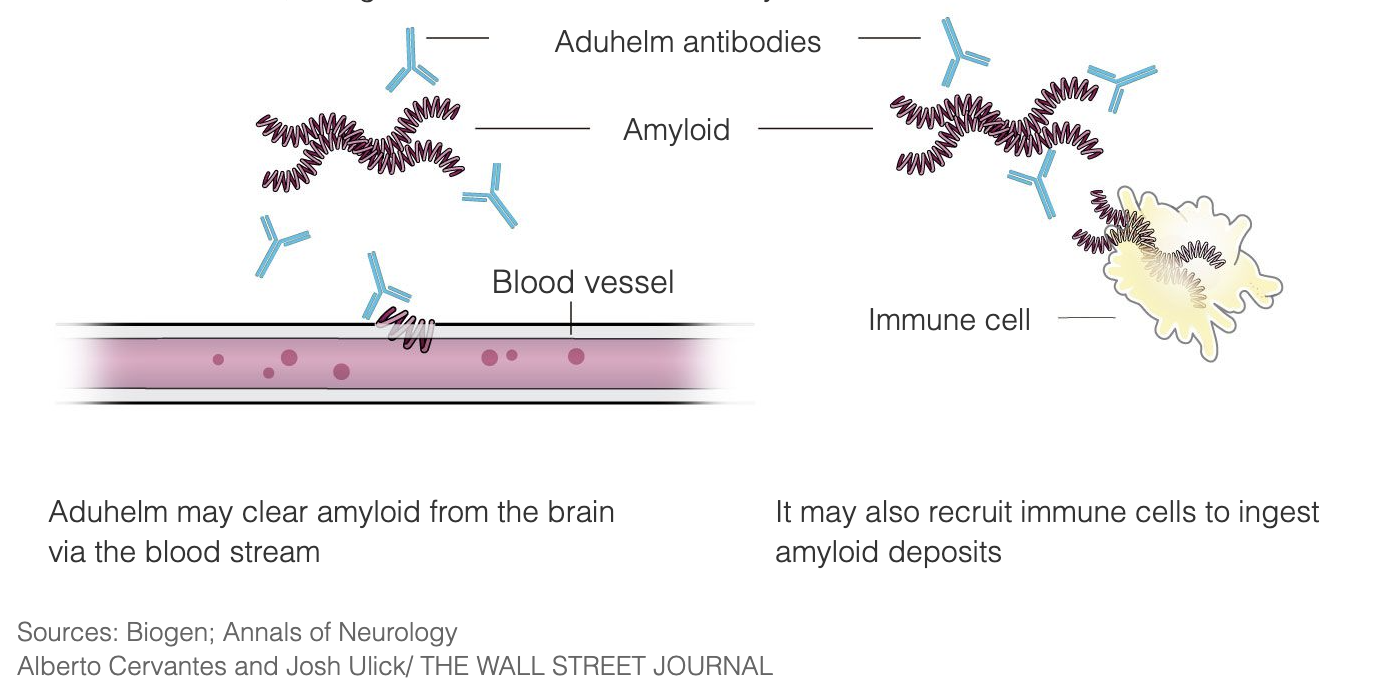
Las placas amiloides han sido un objetivo de la investigación y el desarrollo de medicamentos para la enfermedad de Alzheimer durante 3 décadas, y Aduhelm es uno de esos tratamientos que se han investigado a lo largo de los años.
"La Iglesia de la Santa Amistad"
Los científicos aún no se ponen de acuerdo sobre las causas de la enfermedad de Alzeimer, pero tienen ciertas teorías. Una de ellas se denomina "la hipótesis amiloide" y Aduhelm se desarrolló partiendo de la base de que esta teoría es correcta.
La hipótesis del amiloide afirma que la formación de placas amiloides entre las células cerebrales provoca la muerte de éstas, lo que conduce al deterioro cognitivo. Se trata de una teoría muy antigua que nunca ha sido aceptada universalmente, y el fracaso hasta ahora de los ensayos clínicos dirigidos a las placas amiloides ha envalentonado a sus críticos. Algunos llaman al grupo de partidarios de la teoría "la Iglesia del Santo Amiloide" debido a su reticencia, que raya en el rechazo, a considerar teorías alternativas.
Incluso la función normal del beta-amiloide en el cerebro es discutida por los investigadores, ya que no se ponen de acuerdo sobre qué papel desempeña naturalmente en el cuerpo humano o si es estrictamente un marcador de la enfermedad de Alzeimer.
Un argumento común contra la hipótesis del amiloide es que las placas se encuentran en los cerebros de muchas personas mayores con una cognición normal. Curiosamente, algunos exámenes postmortem de personas de más de 90 años con recuerdos extraordinarios han revelado la presencia de placas amiloides en sus cerebros en diversos grados: algunos de ellos tenían una densidad tan alta que se asemejaban a los casos más graves de Alzheimer, y también tenían muchas más neuronas que las personas que habían muerto con Alzheimer.
Algunos investigadores creen que el beta-amiloide podría tener un papel protector.
George Perry, neurobiólogo de la Universidad de Texas en San Antonio, sugiere que "la acumulación de beta-amiloide y tau es en realidad una respuesta protectora a las presiones metabólicas relacionadas con la edad en la célula", y es especialmente útil para reducir el estrés oxidativo en el cerebro (el estrés oxidativo aumenta con la edad, lo que daña las células).
Varios estudios han investigado otras posibles causas de la enfermedad de Alzheimer. Uno de ellos fue dirigido por investigadores de la Escuela de Medicina Icahn del Monte Sinaí, en Nueva York, que descubrieron que dos cepas de un virus llamado HHV (que forma parte de la familia de los herpesvirus) se encuentran en mayor cantidad en los cerebros de las personas con la enfermedad de Alzheimer. Aunque no es seguro que estos dos virus causen la enfermedad (es más probable que la causa sea la combinación del virus más una determinada variante genética llamada APOE), los datos sugieren que la infección aumenta el riesgo de desarrollar Alzheimer. y que las personas tratadas con medicamentos antivirales tienen diez veces menos probabilidades de desarrollar Alzheimer.
Sin embargo, en apoyo de la teoría del amiloide están los hallazgos genéticos que relacionan los problemas genéticos relacionados con el amiloide con el desarrollo de la enfermedad de Alzheimer de inicio temprano (en personas de 30 a 65 años). El síndrome de Down se considera un factor de riesgo, ya que los investigadores han descubierto que las personas con síndrome de Down tienen una copia extra de un cromosoma que contiene el gen que codifica una proteína amiloide vinculada a la enfermedad de Alzheimer de inicio temprano.
Otras anomalías genéticas pueden dar lugar a la producción de variantes más largas de beta-amiloide, que forman placas con mayor facilidad, o aumentar la producción de beta-amiloide y causar casos algo raros de enfermedad de Alzheimer de inicio temprano. Varios miembros de una misma familia pueden ser portadores de estas mutaciones genéticas y aumentar el riesgo de un individuo de desarrollar Alzheimer de inicio temprano.
Los partidarios de la teoría del amiloide sugieren que los ensayos anteriores con medicamentos dirigidos a las placas amiloides eran simplemente defectuosos. Por ejemplo, un estudio sobre el semagacestat, un inhibidor de la producción de proteínas beta-amiloides, empeoró la cognición de los participantes en el estudio; los investigadores también observaron un aumento del cáncer de piel entre los participantes. Esto podría deberse al hecho de que el semagacestat también inhibía la producción de otras proteínas, no sólo la beta-amiloide, algunas de las cuales tienen funciones importantes en el cuerpo humano.
La explicación más respaldada del fracaso de estos ensayos dirigidos a los amiloides es que los medicamentos son los correctos, pero se administran en el punto equivocado de la progresión de la enfermedad de Alzheimer: se administran demasiado tarde en el proceso de formación de las placas amiloides, un proceso que comienza décadas antes de que aparezcan los síntomas.
Michael Murphy, neurocientífico de la Universidad de Kentucky, señala que "'probablemente ya tenemos un fármaco que podría tratar la enfermedad de Alzheimer, si se lo diéramos a personas de 50 años'".
Existe un importante debate sobre las causas del Alzheimer, y los expertos aún no se han puesto de acuerdo, pero los pacientes y los investigadores han tomado nuevos aires con los resultados del aducanumab en uno de los ensayos clínicos de fase 3 de Aduhelm.
Aduhelm en los ensayos clínicos
Los ensayos clínicos se desarrollan en cuatro fases:
- Fase 0: El medicamento se prueba en cantidades muy pequeñas en menos de 15 participantes para garantizar que no es perjudicial y que el ensayo puede continuar.
- Fase 1: El medicamento se prueba en entre 20 y 80 participantes sin problemas de salud subyacentes para garantizar que no haya efectos secundarios graves. Según la FDA, aproximadamente el 70% de los medicamentos pasan a la fase 2.
- Fase 2: El medicamento se prueba en varios centenares de participantes con la enfermedad para la que se destina el medicamento durante unos meses o años para recabar información sobre su eficacia y efectos secundarios. Aproximadamente el 33% de los medicamentos pasan a la fase 3.
- Fase 3: El medicamento se prueba en hasta 3.000 participantes con la enfermedad para la que se destina el medicamento, y puede durar varios años. El medicamento debe demostrar su seguridad y eficacia. El 25-30% de los medicamentos pasan a la fase 4.
- Fase 4: Esta fase implica a miles de participantes durante muchos años y tiene lugar después de que la FDA haya aprobado el medicamento. Su objetivo es reunir más información sobre su seguridad y eficacia a largo plazo.
Aduhelm en la fase 1
Biogen llevó a cabo varios ensayos clínicos en los que se investigó el aducanumab, empezando por tres ensayos de fase 1 en 2011 en los que se probó el aducanumab en voluntarios sanos y en pacientes con enfermedad de Alzheimer en Estados Unidos y Japón, trabajando con diferentes dosis de aducanumab y placebo. Algunos pacientes estuvieron inscritos durante más de tres años.
En 2016, Biogen publicó los resultados de su ensayo clínico de fase 1, en el que los investigadores administraron infusiones intravenosas mensuales de aducanumab durante un año a los participantes del ensayo con enfermedad de Alzheimer leve. Los participantes tratados con aducanumab experimentaron una reducción de los niveles de beta-amiloide en el cerebro y una ralentización del deterioro cognitivo, medido por una clasificación oficial de demencia clínica. Entre los participantes que recibieron infusiones de aducanumab, los investigadores de Biogen también registraron una reducción de los efectos secundarios, como la ARIA (anormalidades de imagen relacionadas con el amiloide, por ejemplo, edema cerebral o hemorragia en el cerebro). Biogen consideró que estos resultados eran lo suficientemente alentadores como para pasar a la fase 2.
Aduhelm en la fase 2
Biogen comenzó los ensayos de fase 2 a finales de 2018 y evaluó la seguridad de la dosis continuada de aducanumab, además de comprobar la reducción de las placas amiloides y la ralentización del deterioro cognitivo en participantes con enfermedad de Alzheimer en fase inicial y sintomática.
El aducanumab fracasó en su objetivo principal de mostrar un deterioro cognitivo más lento en la marca de 12 meses, pero después de que se revisaran 18 meses de datos del ensayo en un reanálisis, se observaron efectos positivos en una de las cinco dosis: la dosis más alta de aducanumab. La dosis más alta demostró reducir las placas amiloides en el cerebro, así como mostrar respuestas positivas en la cognición.
Se observaron efectos secundarios, al igual que en la fase 1, como ARIA (anomalías en la imagen relacionadas con el amiloide) en aproximadamente el 10% de todos los participantes, y menos del 15% en los participantes que recibieron las dosis más altas de aducanumab.
"Los resultados de 18 meses del ensayo BAN2401 son impresionantes y proporcionan un importante apoyo a la hipótesis del amiloide, dijo Jeff Cummings, director fundador del Centro Lou Ruvo para la Salud Cerebral de la Clínica Cleveland, en una declaración para Biospace.
Aduhelm en la fase 3
Tras los resultados del ensayo de fase 2, Biogen llevó a cabo dos ensayos de fase 3, denominados Engage y Emerge, en los que participaron algo menos de 3.300 personas con enfermedad de Alzheimer relativamente leve en Norteamérica, Australia, Europa y Asia. El aducanumab se administró una vez al mes en dosis bajas y altas por inyección en el torrente sanguíneo y se comparó con los resultados de los participantes que recibieron un placebo.
En marzo de 2019, Biogen detuvo los dos estudios de fase 3, citando un análisis de inutilidad realizado por un comité independiente de supervisión de datos que concluyó que el aducanumab no parecía estar funcionando como se pretendía.
La decisión afectó a 3.300 participantes en el estudio. Los protocolos para participar en el estudio implicaban visitas frecuentes y prolongadas e incluían extracciones de sangre, resonancias magnéticas, escáneres PET y, en ocasiones, punciones lumbares. Siete meses después de la interrupción de los dos estudios, Biogen anunció que un nuevo análisis de los datos adicionales indicaba que, en dosis elevadas, el medicamento parecía reducir el deterioro cognitivo.
Biogen escribió en un comunicado de prensa que los datos adicionales consisten en los resultados de un subconjunto de pacientes del estudio de fase 3 Engage que recibieron una dosis alta de aducanumab y experimentaron una reducción significativa de los deterioros cognitivos y funcionales (memoria, orientación, lenguaje), así como beneficios para las actividades de la vida diaria (hacer las tareas domésticas, ir de compras, viajar de forma independiente fuera de casa). Basándose en estos resultados, Biogen solicitó la aprobación reglamentaria de aducanumab en octubre de 2019 y la recibió a principios de junio de 2021.
Aunque los ensayos clínicos de fase 3 no fueron totalmente concluyentes sobre los beneficios de la terapia en cuanto a la cognición y la función, la FDA concluyó que los ensayos demostraron que el aducanumab, producido bajo el nombre comercial de Aduhelm, puede reducir las placas amiloides, lo que constituyó la base para la decisión de aprobación acelerada de la FDA.
El participante en el ensayo y reportero Phil Gutis escribió para la plataforma de noticias Being Patient: "Me he enterado, gracias a un estudio longitudinal de PET, de que ya no tengo amiloide en el cerebro. El escáner, realizado hace unos dos años en el marco del estudio Aging Brain Cohort del Penn Memory Center, confirmó mis crecientes indicios de que el aducanumab me estaba ayudando. Empecé a sentir que salía de una niebla mental constante... En el lado negativo, los recuerdos que he perdido no han vuelto".
Efectos secundarios y contraindicaciones de Aduhelm
Según la Guía del Medicamento de Biogen, antes de considerar Aduhelm, los pacientes deben informar a sus proveedores de atención médica de todas sus condiciones médicas, incluyendo si son:
- está embarazada o planea estarlo
- está amamantando o planea amamantar
Los pacientes deben informar a sus proveedores de atención médica sobre cualquier medicamento que tomen, incluidos los medicamentos con y sin receta, las vitaminas y los suplementos de hierbas.
Según la Guía del Medicamento de Biogen, el principal efecto secundario conocido de Aduhelm es la ARIA (anormalidades de imagen relacionadas con el amiloide), como el edema cerebral y la hemorragia en el cerebro. Los otros efectos secundarios son:
- reacciones alérgicas graves, como hinchazón de la cara, los labios, la boca o la lengua y urticaria
- dolores de cabeza
- diarrea
- confusión/delirio/alteración del estado mental/desorientación
- cae
La ARIA es un efecto secundario común que no suele causar ningún síntoma, pero que puede ser grave. Lo más habitual es que se manifieste como una hinchazón temporal en el cerebro que suele resolverse por sí sola con el tiempo. Al mismo tiempo, al eliminar el amiloide del cerebro también se elimina el amiloide de los vasos sanguíneos, lo que puede crear pequeños puntos de hemorragia en la superficie del cerebro.
Se observó ARIA en el 41% de los participantes en los ensayos clínicos que recibieron aducanumab, en comparación con el 10% de los participantes que recibieron un placebo.
Aunque la mayoría de las personas con inflamación en áreas del cerebro no presentan síntomas, alrededor del 30% de las personas pueden tener síntomas leves, como:
- confusión
- dolores de cabeza
- mareos
- cambios en la visión
- náuseas
Daniel Gibbs, neurólogo jubilado y participante durante mucho tiempo en los ensayos clínicos de Aduhelm , compartió su experiencia con un efecto secundario extremadamente raro de ARIA:
"Debo decir en primer lugar, y este es el dogma que es en gran medida cierto, que [las ARIA] suelen ser benignas. La mayoría de la gente no sabe que la tiene. Sólo se detectan en las resonancias magnéticas, en las que se observan pequeñas zonas de inflamación o pequeñas zonas de deposición de hierro debido a las hemorragias. Si la gente tiene síntomas, suelen ser leves. El dolor de cabeza es el más común, ocasionalmente la confusión.
Pero casi siempre, incluso con ARIA sintomática, si se deja el fármaco, desaparecen en unos meses. El fármaco puede reiniciarse de nuevo con seguridad. Ha habido muy pocos casos, al menos que hayan sido discutidos por el fabricante del medicamento Biogen, [de] ARIA catastróficos o graves, y el mío estaba en esa categoría. [...]
Empecé a tener más dolores de cabeza. No es raro que me duela la cabeza, así que no le di importancia, pero se volvieron un poco más frecuentes y quizás un poco más graves, pero aún se aliviaban con [medicamentos] de venta libre. [...]
Entonces, una o dos noches antes de la Navidad de 2017, tuve el peor dolor de cabeza de mi vida, del tipo que nosotros, como neurólogos, asociaríamos con una hemorragia subaracnoidea, una hemorragia masiva en el cerebro. Me tomé la presión arterial y estaba por las nubes y se mantuvo alta, así que pensé que estaba teniendo un derrame cerebral.
Hice que mi esposa me llevara a la sala de emergencias, y para cuando llegué a nuestro hospital local, realmente no podía dar una historia coherente. [...]
Pero a los pocos días ya estaba un poco mejor. El dolor de cabeza desapareció, pero seguía teniendo problemas para leer. Durante el mes siguiente, empeoró un poco. La resonancia magnética que me hicieron para entonces mostró que se trataba de ARIA, tanto por la hinchazón como por la hemorragia en todo el cerebro. Como aumentó, se consideró que debía ser tratado. Recibí cinco dosis de esteroides en alta dosis y eso alivió inmediatamente el dolor de cabeza y la confusión. Pero la hinchazón de mi cerebro tardó unos seis meses en desaparecer por completo".
A la luz de estos efectos secundarios potenciales, raros pero graves, los proveedores de atención médica de los pacientes tendrán que realizar exploraciones de resonancia magnética (RM) antes y durante el tratamiento con Aduhelm para comprobar si hay ARIA.
Aprobación de Aduhelm (aducanumab)
El 7 de junio de 2021, la FDA concedió la aprobación acelerada a Aduhelm (aducanumab) para el tratamiento de la enfermedad de Alzheimer.
La aprobación acelerada es un tipo de aprobación que puede concederse a los medicamentos que muestran un efecto terapéutico positivo en los ensayos clínicos, antes de que se hayan presentado todas las pruebas concluyentes. Solo puede aplicarse a medicamentos para enfermedades graves que cubran una necesidad médica no cubierta; el último medicamento aprobado para el tratamiento de la enfermedad de Alzheimer se aprobó hace más de 18 años.
La aprobación acelerada se concede de forma condicional. La FDA exige al fabricante, Biogen, que lleve a cabo un nuevo ensayo clínico para verificar el beneficio clínico del medicamento. Si el ensayo no muestra beneficios, la FDA podría retirar la aprobación del medicamento. Biogen tiene hasta 2029 para completar otro ensayo clínico que confirme los beneficios del aducanumab para los pacientes con Alzheimer; los expertos sostienen que un tercer ensayo clínico, que podría completarse en dos años, habría sido una mejor opción que esperar ocho años para saber si el medicamento funciona, mientras los pacientes se someten al costoso tratamiento y esperan lo mejor.
Una polémica médica con tintes económicos
La decisión de la FDA de aprobar el aducanumab ha desconcertado a los expertos, que afirman que no hay suficientes pruebas de que Aduhelm sea un tratamiento eficaz para la enfermedad de Alzheimer. Muchos de ellos, incluido un panel independiente, aconsejaron a la FDA que las pruebas disponibles planteaban dudas significativas de que el aducanumab pudiera ralentizar el deterioro cognitivo y debatieron si los resultados positivos de sólo uno de los dos estudios de fase 3 son base suficiente para la aprobación de la FDA.
Poco después de la aprobación, tres científicos dimitieron en protesta del comité independiente que asesoró a la FDA sobre el tratamiento, alegando la falta de pruebas convincentes. También criticaron la decisión de la FDA de aprobar el aducanumab para cualquier persona con Alzheimer, a pesar de que el ensayo se llevó a cabo en Alzheimer en fase inicial, y la aceptación de la teoría de que la reducción de la placa amiloide realmente ralentizaría sus síntomas cognitivos (a pesar de que la comunidad científica no está de acuerdo con su validez).
La decisión de la FDA de aprobar el aducanumab en estas condiciones podría tener varias ramificaciones.
- Otros medicamentos dirigidos a las placas amiloides, como el donanemab de Eli Lilly, podrían ser aprobados más rápidamente de lo previsto, lo que estimularía el interés de las empresas farmacéuticas por invertir en medicamentos para el Alzheimer o por seguir participando en los ensayos existentes.
- La decisión de la FDA ha creado una percepción de flexibilidad regulatoria que podría incentivar a otras empresas biotecnológicas a desarrollar medicamentos para afecciones raras, un impulso que se ha desinflado tras una larga cadena de fracasos en ensayos clínicos, especialmente en los 18 años transcurridos entre la aprobación de tratamientos para el Alzheimer.
- El medicamento es bastante costoso, 56.000 dólares al año, lo que significa que las tarifas de los seguros médicos privados podrían aumentar, ya que las aseguradoras tendrán que pagarlo, y aumentará la carga de los contribuyentes como parte de Medicare (el seguro médico nacional de EE.UU.). Algunos dicen que podría ser "devastador" para Medicare, no sólo por sus costes básicos, sino también porque el tratamiento con Aduhelm requiere que los pacientes tengan diagnósticos más tempranos con punciones espinales para detectar el amiloide y un seguimiento constante con resonancias magnéticas (entre otros), lo que aumenta significativamente los costes y ejerce presión sobre los sistemas médicos.
La aprobación también se considera una ganancia inesperada para Biogen, ya que sus acciones subieron más del 50%, mientras que las de su socio japonés Eisai Co. subieron un 56%. Aduhelm podría cosechar unos 10.000 millones de dólares en ventas, según predicen los analistas, teniendo en cuenta que sólo en EE.UU. hay 6 millones de personas diagnosticadas con la enfermedad de Alzheimer. El medicamento es importante para el crecimiento de Biogen, ya que la competencia ha perjudicado las ventas de sus medicamentos - Tecfidera para la esclerosis múltiple (EM), y Spinraza para la atrofia muscular espinal (AME).
Spinraza es otro medicamento de la cartera de Biogen con un precio elevado, con un precio de lista de 750.000 dólares para el primer año de tratamiento y 375.000 dólares al año a partir de entonces.
No todos critican la decisión de la FDA de aprobar Aduhelm
Dado que el Alzheimer es una enfermedad progresiva, los pacientes necesitan un tratamiento cuanto antes. La noticia de la decisión de la FDA ha dado nuevas esperanzas a muchos, bien porque el tratamiento funcione para ellos mismos o para sus seres queridos, bien porque estimule a otras empresas a desarrollar otros tratamientos contra el Alzheimer.
Los grupos de defensa de los pacientes habían presionado enérgicamente para que se aprobara porque sólo hay otros seis tratamientos disponibles para esta enfermedad debilitante, que sólo tratan los síntomas durante unos meses. En noviembre de 2020, el comité asesor de la FDA votó en contra de la aprobación de Aduhelm, lo que desató la ira y luego la acción de la Asociación de Alzheimer, que entonces hizo una campaña para expresar su apoyo al potencial del fármaco y subrayar la necesidad de esperanza y progreso.
En enero de 2021, la FDA y los grupos de pacientes se reunieron en una sesión de escucha en la que pacientes, cuidadores, clínicos y defensores se mostraron a favor del tratamiento, argumentando, entre otras cosas, que los pacientes no pueden permitirse esperar más tiempo por un tratamiento.
El director de la Oficina de Nuevos Medicamentos de la FDA, Peter Stein, confirmó en una rueda de prensa que la opinión de los pacientes había influido. Dijo que la FDA "escuchó muy claramente a los pacientes que están dispuestos a aceptar cierta incertidumbre para tener acceso a un medicamento que podría proporcionar un beneficio significativo en la prevención de la progresión de esta enfermedad, que como todos sabemos, puede tener consecuencias muy devastadoras."
Patrizia Cavazzoni, directora en funciones del Centro de Evaluación e Investigación de Medicamentos de la FDA, dijo durante la misma conferencia de prensa que "los datos apoyan que los pacientes y los cuidadores puedan elegir el uso de este medicamento."
"Esta aprobación del fármaco por parte de la FDA marca el inicio de una nueva era en el tratamiento y la investigación del Alzheimer", dijo la doctora María Carrillo, directora científica de la Asociación del Alzheimer. "La historia nos ha demostrado que la aprobación del primer fármaco de una nueva categoría vigoriza el campo, aumenta las inversiones en nuevos tratamientos y fomenta una mayor innovación".
¿Cuándo se aprobará Aduhelm en Europa?
La enfermedad de Alzheimer se está convirtiendo rápidamente en una de las principales crisis médicas, económicas y sociales del siglo, y es difícil de detectar en una fase temprana, especialmente si se tiene en cuenta la falta de especialistas en Europa que puedan confirmar un diagnóstico. Solo en Europa, en 2018, 9,7 millones de personas padecen la enfermedad de Alzheimer y otras formas de demencia; para 2030, se prevé que el número de pacientes aumente a 14 millones, lo que crea una necesidad imperiosa de tratamientos eficaces.
Aduhelm aún no ha sido aprobado fuera de los Estados Unidos. Biogen ha solicitado la revisión reglamentaria en la Unión Europea en octubre de 2020, así como en Japón, Canadá, Australia y Brasil a finales del año 2020.
Según la Agencia Europea de Medicamentos (EMA), la evaluación de una solicitud de autorización de comercialización de un nuevo medicamento suele durar alrededor de un año, menos si el promotor del medicamento recibe una evaluación acelerada.
En marzo de este año, la planta de fabricación de Biogen en Suiza, con un coste de 2.000 millones de dólares, recibió la licencia de Buenas Prácticas de Fabricación (BPF) de la Agencia Suiza de Productos Terapéuticos (Swissmedic). Biogen tiene previsto solicitar la aprobación de la FDA para producir Aduhelm en las instalaciones su izas a finales de 2021 y espera suministrar el medicamento a más de un millón de pacientes al año.
Acceso a Aduhelm fuera de Estados Unidos
Aduhelm está actualmente aprobado por la FDA y disponible para los residentes de los Estados Unidos - y hay regulaciones que permiten la importación de medicamentos en países donde no están actualmente aprobados.
Los pacientes con enfermedades potencialmente mortales o debilitantes tienen derecho a acceder, comprar e importar medicamentos con la ayuda de sus médicos tratantes.
Los pacientes y sus médicos pueden hacerlo sobre la base de la normativa de uso compasivo o de importación de pacientes designados, una excepción legal a la regla general de que normalmente sólo se puede acceder a un medicamento tras la autorización/aprobación de mercado (sea cual sea la expresión que utilicemos) en el país donde vive el paciente. Esta excepción permite a los pacientes acceder de forma legal, ética y segura a medicamentos que aún no están aprobados en su país.
Lea más sobre la "base del paciente nombrado" aquí (EMA).
everyone.org se comprometen a que los pacientes y sus médicos tratantes puedan tener acceso a cualquier medicamento disponible en todo el mundo para el mejor tratamiento posible. Si se encuentra fuera de los Estados Unidos, operamos cumpliendo al 100% la normativa de su país. Si desea obtener más información, acceder al medicamento o ponerse en contacto con nuestro equipo de asistencia, puede hacerlo aquí.
¿Cuánto cuesta Aduhelm ?
Biogen ha anunciado que el coste de Aduhelm a la dosis de mantenimiento (10 mg/kg) para un paciente medio sería de 56.000 dólares al año. Eso no incluye las pruebas que los pacientes tienen que hacer antes del tratamiento y durante el mismo.
Biogen ha recibido críticas por el elevado precio del medicamento al año.
El Instituto para la Revisión Clínica y Económica (ICER), sin ánimo de lucro, que analiza los precios de los medicamentos, indicó que un precio anual justo oscilaría entre 2.500 y 8.300 dólares por paciente cada año. En un comunicado, el ICER dijo que la aprobación de la FDA no protegía a los pacientes, y que Biogen podría recaudar más de 50.000 millones de dólares al año "incluso a la espera de pruebas que confirmen que los pacientes reciben beneficios reales del tratamiento."
El director general de Biogen, Michel Vounatsos, ha respondido a las críticas asegurando que el precio del medicamento está justificado por el valor que aportará a los pacientes y a una sociedad menos agobiada por el Alzheimer, y que el precio es un reflejo de "dos décadas sin innovación". "Es hora de invertir en el tratamiento", añadió.
En everyone.org, no podemos influir en el precio fijado por Biogen. Podemos ayudar a los pacientes a acceder a Aduhelm a los siguientes precios:
- 1.958,58 euros por un vial de 170 mg/1,7 mL (100 mg/mL)
- 3.046,68 euros por un vial de 300 mg/3 mL (100 mg/mL)
Haga una consulta aquí para obtener más información.
Próximos tratamientos para la enfermedad de Alzheimer
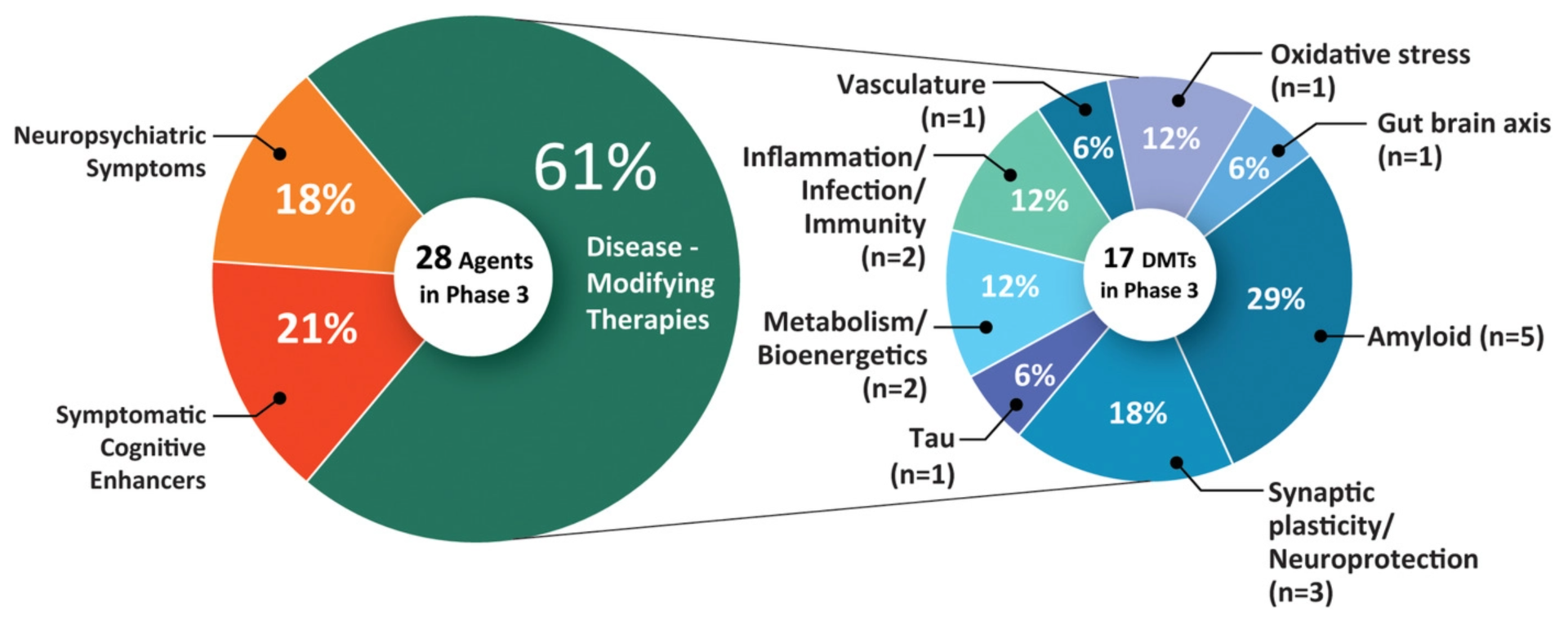
Un estudio publicado en mayo de 2021 muestra que actualmente hay 126 tratamientos enfase de ensayo clínicopara la enfermedad de Alzheimer. El 82,5% de ellos tienen como objetivo la modificación de la enfermedad, el 10,3% mejoran la cognición y el 7,1% se centran en aliviar los síntomas neuropsiquiátricos.
- Ensayos de fase 3: 28 tratamientos (incluyendo aducanumab)
- Ensayos de fase 2: 74 tratamientos
- Ensayos de fase 1: 24 tratamientos
Lo más probable es que los tratamientos en fase 3 se aprueben el próximo año.
Lecanemab
El anticuerpo monoclonal lecanemab, que funciona de forma similar al aducanumab (desencadenando que el sistema inmunitario elimine las placas de beta-amiloide), resulta prometedor, según los informes publicados, y ha pasado a la fase 3 de los ensayos clínicos.
Gantenerumab
El gantenerumab se une al beta-amiloide, en particular a las placas de beta-amiloide en comparación con el beta-amiloide individual que circula en la sangre. Se cree que disuelve las placas de amiloide y elimina el beta-amiloide estimulando la fagocitosis, un proceso en el que una célula toma una determinada molécula dentro de sí y la digiere. Los estudios clínicos anteriores de gantenerumab demostraron que reducía las placas de beta-amiloide de las personas con la forma más común de Alzheimer que no está causada directamente por mutaciones genéticas. Se sigue estudiando en dos grandes estudios globales de fase III.
Solanezumab
El solanezumab es un anticuerpo que pretende "limpiar" el beta-amiloide de la sangre y el líquido cefalorraquídeo, evitando así la formación de placas. Los beneficios se registraron en los participantes que tomaron parte en el periodo completo de tres años y medio de los ensayos, y en menor medida en los participantes que se incorporaron más tarde, por lo que aún queda por conocer sus efectos.
Donanemab
Donanemab parece ser otro prometedor medicamento para el tratamiento del Alzheimer. Lo está probando Eli Lilly and Company, que tiene previsto inscribir a 1.500 participantes en un gran estudio para confirmar los resultados de su estudio más pequeño; este estudio anterior duró 76 semanas e incluyó a 257 pacientes, y, según los informes, demostró que el donanemab ralentizaba significativamente el progreso de la enfermedad de Alzheimer.
Otros
El saracatinib es un compuesto experimental que actúa como inhibidor de una proteína llamada Fyn quinasa que ayuda a la formación de placas beta-amiloides. Un estudio realizado en ratones demostró que el saracatinib, al inhibir la Fyn quinasa, era eficaz para revertir la pérdida de memoria en los ratones. La inhibición de la quinasa Fyn puede prevenir o retrasar la progresión de la enfermedad.
Los investigadores del Instituto Salk de Estudios Biológicos de California están estudiando una sustancia química llamada fisetina y han desarrollado una versión de la misma denominada CMS121, que ha resultado eficaz para frenar la pérdida de células cerebrales. Se necesitan más investigaciones antes de que el medicamento esté listo para su aprobación.
En relación con la reciente aprobación de Aduhelm, María Carrillo, directora científica de la Asociación de Alzheimer de Chicago (EE.UU.), dijo en una declaración para Nature: "Estamos esperanzados, y esto es el principio, tanto para este fármaco como para mejores tratamientos contra el Alzheimer".
"Todo lo que realmente somos son nuestros pensamientos y nuestro cerebro." - Sandy, antiguo dentista y profesor asistente y paciente de Alzheimer.
En everyone.org, estamos convencidos de que la ciencia hace avanzar a la raza humana y mejora o incluso salva vidas. La enfermedad de Alzheimer está poniendo en peligro la calidad de vida de muchos. Animamos a los científicos dedicados a encontrar una (parte de la) solución a perseverar y esperamos que los tratamientos en desarrollo que muestran resultados prometedores se aprueben y sean accesibles para los enfermos de Alzheimer de todo el mundo en los próximos 3 años.